药物临床试验流程说明及文件下载
药物临床试验立项说明
为保障药物临床试验项目立项流程高效有序,请各位CRA/CRC认真阅读立项说明,按照“立项递交文件清单”要求备齐材料,并将电子版文件上传至临床试验管理系统(CTMS),预约机构立项管理工作人员在线审核以完成立项。
1. 药物临床试验项目立项总体说明:
(1)项目立项方式:请按照如下要求准备电子版立项材料,由CRA在CTMS系统中发起“立项申请”,完成立项信息填写与资料上传,由机构办公室工作人员审核。
请注意:填写完成后请先保存(切勿提交),联系机构办公室杜老师(63138596)预审,预审通过后再完成提交。本中心立项无需费用。
(2)CTMS系统注册账号申请说明、网址及使用操作手册请见“研究平台—药物/器械临床试验机构—服务指南—药物临床试验流程说明及文件下载”。
(3)文件准备和递交伦理/人遗系统:
项目立项同时,伦理(eCRS系统)递交清单请见“北京友谊医院→科研教育平台→临床研究管理办公室→生命伦理委员会-→未上市药物器械递交清单”,如有问题请联系伦理办公室左老师,电话63139003。伦理(eCRS系统)人遗调查表有填写问题请联系邢老师,电话63139386。
2. 立项递交文件准备事项说明
(1)请根据“立项递交文件清单”(附件1)准备立项文件,其中以下文件须经PI签字后,将签字版文件上传至CTMS系统:
√ 机构递交信;
√ 方案签字页;
√ 药物临床试验申请表(附件2,1份);
√ 研究者履历表(附件3);
√ 研究者利益冲突声明(附件4);
√ 保密承诺书(附件5)
√ 药物临床试验多院区单一项目开展申请表(附件6,如适用;适用于作为一个试验项目立项,项目层面的工作由一位PI或Co-PI带领研究团队在两个或多个院区同时开展的项目)
(2)项目文件上传至CTMS系统并通过审核后,项目信息中将显示该项目的立项受理号。该受理号即为伦理系统中提交时需填写的立项受理号。
(3)项目概要表(附件7):需伦理会审的项目,须同时提供项目概要表电子版及纸质版文件。本表信息填写要求:专业负责人请填写科室主任;项目负责人请填写PI;表中右上角编号(格式件:20XX-P1-药XXX)可预留空白,后期手写补充。本表格式要求:小四号字,1.1行距,表格允许跨页断行(请自行设置好)。
(4)知情同意书中伦理联系人请填写左旭,电话:63139003。
(5)如项目涉及中心实验室或第三方实验室,请提供中心实验室/第三方实验室资质、试验所涉及检验的室间质评及正常值范围。
(6)请确保所有立项文件(除机构递交信、药物临床试验申请表、研究者履历表、利益冲突声明及保密承诺书外)均按规定加盖公章(首页+骑缝)。盖章要求:申办方章/CRO章或临床试验专用章均可,但同一项目请保持用章一致;项目授权委托书需由委托方盖章;各公司资质请加盖本公司公章。
(7)伦理及人遗相关空白表格模板请在“北京友谊医院官网→科研教学→研究平台→临床研究管理平台”中下载。
(8)立项时需提交组长单位伦理通过批件。如项目涉及多家组长单位,须同时提供所有组长单位的伦理通过批件。
3. CTMS系统填写立项信息和上传立项文件时应注意:
(1)立项信息填写时应注意:
① CTMS系统立项时需填写以下信息:药物信息;申办方信息;CRO信息(如适用);SMO信息(如适用);科室负责人信息(科主任);CRA信息;CRC信息;研究单位(至少添加组长单位)及研究者、例数信息。
② 立项时务必在系统里填写项目简称。
(2)上传立项文件时应注意:
① 所有递交文件均须上传至CTMS系统。如系统预设目录中无对应字段,可上传至“其它资料”项。
② 电子版立项文件上传前,请按照递交信目录顺序为文件编号并规范命名,例如:“1.递交信”“4.1主知情同意书”等,文件格式请参照CTMS系统格式备注要求。
③ 请提供国家药品监督管理局药品评审中心官网药物相关网页截图电子版(递交信目录中无需列出),并用红框标出本次立项试验药物(示例见图1)。请将上述截图上传至CTMS系统“立项申请”中“国家药品监督管理局药品审评中心网页截图”字段。
4. 本中心立项申请、伦理申请与合同申请须于同一日内提交完成。
立项申请信息填写系统:CTMS系统
伦理申请信息填写系统:临床研究管理平台(eCRS系统)
协议上传系统:CTMS系统,立项当天请提交未定稿版本(备注未定稿版)。
(协议有疑问可联系杨老师,电话63138628)
5. 本中心伦理会每月定期召开,开会安排请查阅北京友谊医院官网“科研教学→生命伦理委员会→会议时间”。
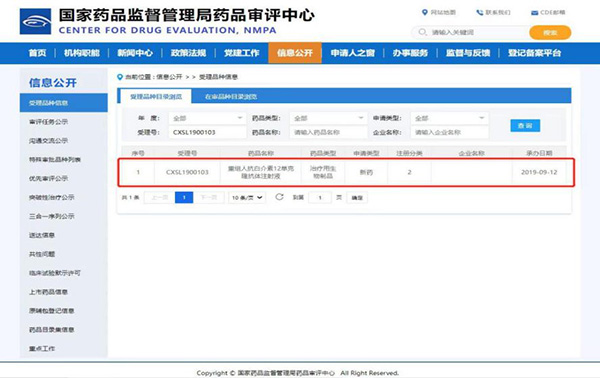
图1. 国家药品监督管理局评审中心药物相关信息网页截图
文件下载链接:药物临床试验立项说明(2026.01更新).docx
首都医科大学附属北京友谊医院
药物临床试验机构办公室
2026年01月
附件下载:
上一篇: 临床试验协议(合同)签署说明
下一篇: 药物临床试验项目启动说明


 微博
微博 微信
微信

 京公网安备11010202008305号
京公网安备11010202008305号